وارفارین دارویی است که قابلیت انعقاد خون را کاهش می دهد .همه بیماران قلبی که دارای دریچه مصنوعی هستند با این نام و این دارو به خوبی آشنا هستند . وارفارین اصلی ترین عضو خانواده كومارین ها و پرمصرف ترین داروی ضدانعقاد خوراكی جهان می باشد که جهت پیشگیری از ترومبوآمبولی وریدی و ریوی، سکته مغزی در بیماران با آرتریال فیبریلیشن و تشکیل لخته بعد از نصب دریچههای مصنوعی قلب و انفارکتوس قلب تجویز می گردد.
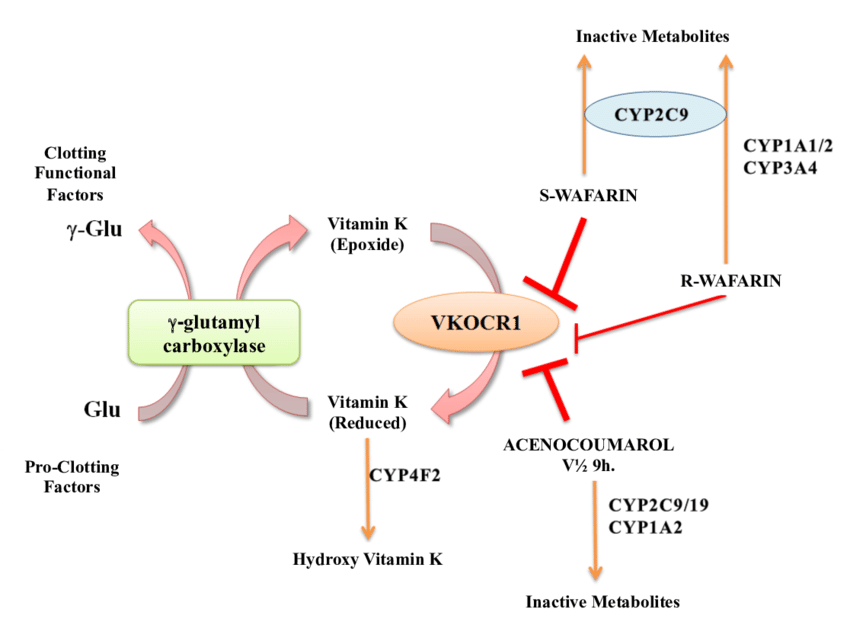
این دارو با مهار تولید فاکتورهای انعقادی وابسته به ویتامین K در کبد در افراد با بیماریهای قلبی، ریوی و عروقی جهت جلوگیری از ایجاد لخته استفاده میگردد. این مسیر در مسیر سنتز ترومبین و دیگر فاکتورهای انعقاد از جمله فاکتور II، VII، IX، و X میباشد.
برخی مواد غذایی و داروها با وارفارین تداخل ایجاد میکنند. افزایش مصرف مواد غذایی سرشار از ویتامین K باعث کاهش اثر وارفارین و کاهش مصرف این ویتامین باعث افزایش اثر وارفارین و در نتیجه احتمال بروز خونریزی میشود.
وارفارین اثر ضد انعقادی خود را از شروع مصرف بعد از دو روز الی یک هفته نشان میدهد که میزان آن توسط تستهای آزمایشگاهی PT وINR ، بنا به دستور پزشک تنظیم میشود. پایین بودن میزان INR ریسک بالایی برای ایجاد لخته خونی و بالا بودن آن ریسک بالایی برای خونریزی دارد. سالانه تعدادی از بیماران مصرف كننده وارفارین دچار خونریزی كشنده شده و برخی نیز عوارض خفیف خونریزی دهنده را بروز می دهند. بنابر این پایش دقیق وضعیت انعقادی خون بیماربرای دوز درمانی مناسب ضروری است.
اثر این داروی ضد انعقاد به دلیل عوامل فارماكودینامیك، فارماكوكینتیك و خصوصاً عوامل فارماكوژنتیك به طور گسترده در بین بیماران متغیر است. به دلیل تفاوتهای فردی مانند سن، رژیم غذایی، مصرف سیگار، وزن و ژنتیك، كه مهمترین آنها تفاوتهای ژنتیكی است، میزان دوز لازم داروی ضد انعقاد برای بیماران مختلف یكسان نمیباشد. بنابراین مصرف كم یا زیاد وارفارین میتواند منجر به عوارض مرگ آوری نظیر خونریزی یا ترومبوز گردد.
استفاده زیاد از این دارو با کم کردن قابلیت انعقاد خون می تواند منجر به خونریزی های گاه مرگبار شود .در این حال شروع خونریزی معمولاّ در مویرگهای زیر جلدی است که با کمترین ضربه به بدن لکه های تیره رنگی که نشانه خونریزی زیر جلدی است در نقاط مختلف بدن به وجود می آید .
این علامت نشانه آن است که مقدار وارفارین مصرف شده بیش از حد لازم بوده است .در چنین وضعیتی لازم است سریعاّ با مراجعه به پزشک و انجام آزمایش معروف به PTوضعیت انعقادی خون را تعیین کرد . ممکن است لازم باشد بیمار برای یکی دو روز از خوردن وارفارین اجتناب کند یا حتی در بیمارستان بستری شود . با وجود این همیشه وضع بدین صورت نیست . گاهی حتی بدون پیدایش علایم خونریزی زیر پوستی ممکن است خونریزی در نقاط دیگر بدن از جمله مفاصل دستگاه گوارش و بدتر از همه در داخل مغز به وجود آید . این مخاطرات ایجاب می کند که بیماران دریچه ای قلب بر طبق یک برنامه منظم با انجام آزمایش PT از مقدار داروی وارفارین مصرفی که به وسیله پزشک تعیین می شود همواره با اطلاع باشند .
- آن دسته از بیمارانی که دریچه آنها از نوع فلزی است جهت جلوگیری از ایجاد لخته خون باید قرص وارفارین مصرف کنند. مصرف نکردن آن بیماران را با مشکلات بسیار حاد و جدی روبرو خواهد کرد. درصورتیکه نوع دریچه خوکی یا انسانی باشد نیازی به مصرف وارفارین نیست مگر آنکه ریتم قلب نامنظم باشد. البته در دریچه های خوکی هم در چند ماه اول بعد از عمل، مصرف وارفارین لازم است (تحت نظر پزشک معالج). این قرص با تاثیر برروی یک سری از فاکتورهای انعقادی خون، زمان انعقاد آن را افزایش میدهد. تاثیر این دارو را آزمایشی بنام زمان پروترومبین (PT ) و نسبت بین المللی (INR ) تعیین میکند.
آزمایش PT
مقدارطبیعی PT بین13-12 ثانیه است. اما در کسانی که تعویض دریچه شدهاند و وارفارین مصرف میکنند بین 25-18 ثانیه (براساس نوع محل و تعداد دریچه) تنظیم میگردد.
آزمایش INR
مقدار طبیعی آن 1 میباشد . در مصرف کنندگان وارفارین بین 5/3 – 2 تنظیم میگردد . البته بر اساس نوع، محل و تعداد دریچه در افراد مختلف فرق میکند.
تا زمانیکه در بیمارستان بستری هستید روزانه یکبار باید آزمایش PT-INR انجام شود تا مقدار لازم قرص وارفارین مشخص شود. پس از ترخیص، دو روز و سپس یک هفته و بعد 2 هفته و در صورت کنترل آن و مشخص شدن مقدار قرص وارفارین ، ماهی یک بار انجام این آزمایش کافی است . البته در بعضی از بیماران انجام مکرر این آزمایش با نظر پزشک معالج لازم است. پس از هر بار آزمایش مقدار PT-INR را به اطلاع پزشک معالج خود برسانید .
مصرف طولانی مدت وارفارین در صورتیکه بطور منظم با انجام آزمایش خون همراه باشد و قرص وارفارین بر اساس جواب PT-INR تجویز شود و میزانPT-INR کنترل گردد هیچ مشکلی ایجاد نخواهد کرد. اما اگر PT-INR را کنترل نکنید و مقدار آن از حد مجاز بالاتر رود و مثل گذشته مقدار وارفارین نیز تغییری نکند و کاهش نیابد، دچار خونریریهای مختلف میشوید و در صورتیکه PT-INR کمتر از حد لازم باشد ، امکان لخته شدن دریچه مصنوعی وجود دارد.

برخی از داروهایی که باعث افزایش PT- INR می شوند عبارتند از:
آسپرین - بروفن - ایندومتاسین - مفنامیک اسید - داروهای ضد قند - سایمتدین - آلوپرینول- کلوفیبرات - جم فیبروزیل - هپارین - ایزونیازید - متی مازول - مترونیدازول - مصرف مشروبات الکلی - کلرامفنیکل - اریترومایسین - دانازول - دیازوکساید - دکستروتیروکسین - گلوکاگون - هپارین - واکسن انفولولانزا - کتوکونازول - مپریدین - متوتروکساید - متیل دوپا - نالیدیکسیک اسید - نفیدیپین یا آدالات - فنیل بوتازون - کینیدین - استرپتوکیناز - هورمونهای تیروئید - وراپامیل - ویتامین -A ویتامین E
برخی از داروهایی که باعث کاهش PT- INR می شوندعبارتند از:
قرص های ضد بارداری - کاربامازپین - شربت معده - سیگار- ویتامینk- قرصهای ادرارآور- کلروبوتانول- کولسلیرامین- ریفامپین- استروژنها- داروهایملین
نکات قابل توجه حین مصرف قرص وارفارین
*مقدار مصرف دارو بستگی به نظر پزشک شما دارد . پس خودسرانه مقدار آنرا کاهش یا افزایش ندهید .
*از آنجایی که مقدار مصرف دارو در اشخاص مختلف ، متفاوت است هیچگاه مقدار مصرفی خود را به دیگری توصیه نکنید.
*دارو را همیشه در ساعت معینی از روز مصرف کنید . بهتر است عصرها باشد.
*دارو را دور از دسترس اطفال نگهدارید.
*دارو را در ظرف شیشه ای و بدور از نور، رطوبت و گرما نگهدارید.
*قرص وارفارین را با معده خالی مصرف کنید تا بهتر جذب شود.
*درصورتیکه احتمال فراموش کردن مصرف دارو را می دهید حتما به یک نفر از اعضاء خانواده بسپارید تا شما را یادآوری کند.
*درصورتیکه مصرف دارو را در یک روز فراموش کردید به محض متوجه شدن در همان روز، دارو را مصرف کنید. اما اگر روز بعد متوجه شدید، مقدار آنرا 2 برابر نکنید. حتما فردای آنروز PT-INR را چک کنید و به پزشک خود اطلاع دهید.
*در صورت مصرف هرگونه دارو همزمان با وارفارین حتی قرصهای ویتامین حتما با پزشک خود مشورت کنید. (مصرف همزمان وارفارین با ویتامین K مجاز نیست).
*هنگام کار با وسایلی که ممکن است موجب جراحت ، زخم و خونریزی شوند، احتیاط لازم را بعمل آورید و به خاطر داشته باشید که در صورت بریدگی، خون شما دیرتر از زمان عادی بند می آید.
*کارت شناسایی خود را همیشه همراه داشته باشید. ( کارتی که نوع بیماری - نوع عمل جراحی و نوع دریچه در آن ذکر شده باشد.)
*همزمان با مصرف وارفارین از قرص آسپرین و بروفن بعنوان مسکن استفاده نکنید.
*در صورت بروز تب- ابتلا به بیماری خاص - تغییر در رژیم غذایی مانند دیابت و بطور کلی بروز هر اتفاق جدیدی را به پزشک خود یا هر پزشک قابل دسترس دیگری اطلاع دهید.
*علایم هشداردهنده افزایش PT-INR که با بروز آن به پزشک خود باید مراجعه کنید:
• خونریزی از لثه هنگام مسواک زدن
• وجود مدفوع سیاه رنگ
• خونریزی زیر جلدی
• کبودی بی دلیل روی پوست
• خونریزی بی دلیل از بینی
• خونریزی شدید و غیر طبیعی در دوران قاعدگی
• درد یا تورم شکم
• پیدایش خون در ادرار
• یبوست شدید
• سرفه یا خلط خونی
• سرگیجه
• سردرد شدید مداوم
• درد ، سفتی یا تورم مفاصل
• استفراغ خونی
نکته :
* کسانیکه قرص آهن یا فروسولفات مصرف میکنند نیز رنگ مدفوعشان سیاه رنگ میشود که نشانه خونریزی داخلی نیست.
*بصورت دوره ای هر 6 ماه یکبار آزمایش ادرار و مدفوع بدهید.
بیماران همیشه به خاطر داشته باشند که تفسیر آزمایش PT و تعیین مقدار وارفارین مورد مصرف فقط به عهده پزشک است .
از طرف دیگر وارفارین اگر به مقدار کافی مصرف نشود خطر لخته شدن خون در برخورد خون با دریچه های مصنوعی وجود دارد و متاسفانه مخاطرات این عارضه کمتر از زیادی مصرف وارفارین نیست . بیماران دریچه ای قلب آگاه باشند که برای تمام عمر می بایست از این دارو استفاده کنند .
جالب این است که مقدار مصرف وارفارین در مورد نوع دریچه و حتی وضعیت قرار گرفتن دریچه هم فرق می کند .به عنوان مثال بیماران با دریچه مصنوعی در وضعیت دریچه میترال همیشه باید بیش از بیمارانی که دریچه در وضعیت آئورت دارند وارفارین مصرف کنند .
موضوع با اهمیت برای همه بیماران قلبی که به هر دلیل از داروی ضد انعقادی مصرف می کنند این است که بسیاری از داروها و بعضی مواد غذایی قدرت اثر داروی ضد انعقادی را کم و زیاد می کنند .
این گونه بیماران لازم است حتما ّاز این داروها و مواد غذایی با اطلاع بوده و حتی المقدور از مصرف آنها توام با داروی وارفارین خودداری نمایند و در صورتی که بهر دلیل مصرف آنها اجتناب ناپذیر است در طی این مدت آزمایشPT را با فواصل کمتری انجام دهند .
با وجود رعایت همه جوانب باز هم متاسفانه تعدادی از بیماران دریچه ای قلب که داروی ضد انعقاد مصرف می کنند به دلیل استفاده از مصرف بیش از حد لازم و یا کمتر از حد لازم دچار عارضه می شوند.
تنها اطلاع کافی و رعایت دستورات پزشک و انجام آزمایش PTمنظم می توانند این مخاطرات را به حداقل ممکن کاهش دهد .
نکاتی در باره داروهای ضد انعقادی
بیماران قلبی که دریچه مصنوعی داشته و لازم است برای تمام عمر از داروهای ضد انعقادی استفاده نمایند در صورتی که راجع به این دارو مزایای آن و عوارض آن اطلاعات نسبتاّ جامعی داشته باشند بدون تردید از مزایای این دارو بیشتر بهره مند خواهند شد و عوارض دارو کمتر از دیگران گریبان آنها خواهد گرفت.این دارو امروزه در اغلب کشورهای جهان مورد استفاده قرار می گیرد و در کشور ما نیز منحصرا از وارفارین استفاده می شود .
چگونگی مصرف وارفارین
آزمایش خون موسوم به PT میزان به اصطلاح رقیق شدن خون را مشخص می کند .تنها راه مصرف صحیح وارفارین انجام آزمایش PT است فواصل زمانی انجام آزمایش بستگی به عوامل متعددی دارد.وارفارین وقتی که برای اولین بار مصرف می شود معمولاّ 5-3 روز طول می کشد تا اثر درمانی آن ظاهر شود و بیمارانی که به دلایلی نیاز دایم به استفاده از داروهای ضد انعقادی دارند در طی این مدت 5-3 روز می بایست از هپارین تزریقی برای آنها استفاده کرد و استفاده توام این دو به دلیل اثرات متفاوتی که در چگونگی مکانیسم تاثیر دارند هیچگونه تناقضی ندارد و پس از رسیدن PT به حد مورد نیاز می توان هپارین را قطع کرد .
بهر حال تعیین میزان مصرف وارفارین گرچه بر اساس آزمایش PT انجام می شود اما قانون ثابتی نداشته و از بیماری به بیمار دیگر بر حسب شرایط قلبی جسمانی و حتی اجتماعی متفاوت است بنا بر این اگر بدلایلی می بایست مرتباّ وارفارین بخورید حتماّ به خاطر داشته باشید که مقدار مصرف وارفارین شما را فقط آزمایش PT تعیین نمی کند .در واقع این پزشک شما است که با آگاهی به شرایط و وضعیت شما نسبت به مقدار مصرف داروی وارفارین برای شما تصمیم مناسب و مقتضی را خواهد گرفت .
بیماران باید بدانند که مصرف کمتر از حد لازم وارفارین به همان اندازه مصرف بیش از حد آن میتواند مخاطره آمیز و حتی مهلک باشد .همه بیمارانی که کومادین مصرف می کنند لازم است دفترچه و یا بهر حال نشانه ای همراه خود داشته باشند که حکایت از مصرف منظم و مداوم وارفارین داشته باشد .
داروهایی که روی وارفارین اثر می کنند و نتیجه درمانی آنرا تغییر می دهند از لیست طویل و بلند بالایی تشکیل شده که نیازی نیست بیماران از آن آگاهی داشته باشند اما چون بدون یادآوری از آن فصل مربوط به داروهای ضد انعقاد کامل نخواهد بود بنابر این به اختصار نام برده می شود. فهرست زیر شامل کلیه داروها و موادی است که اثر وارفارین را افزایش می دهند و مصرف آنها همراه با وارفارین توصیه نمی شود در موارد بسیار ضروری آزمایش PT حتماّ باید با فواصل کمتر انجام شود .
عوارض دیگر وارفارین
به جز خونریزی که مهمترین عارضه مصرف بیش از حد وارفارین است مصرف وارفارین می تواند عوارض دیگری هم داشته باشد .نکروز پوستی گرچه عارضه کمیابی است ام در مواردی ممکن است دیده شود .این عارضه معمولاّ ظرف چند روز اول درمان پیدا می شود و اغلب قسمتی از پوست را مبتلا می کند که در مجاورت بافت چربی باشد .گفته می شود بیمارانی که نقص پروتیین c دارند دچار این عارضه می شوند .
حاملگی و داروهای ضد انعقادی
وارفارین با عبور از جفت نه تنها می تواند منجر به ناهنجاری مادرزادی شود که ممکن است باعث خونریزی های مرگبار هم در جنین و هم در مادر قبل از تولد و چه بعد از تولد باشد .جراحان قلب به خانمهایکه تعویض دریچه قلب شده و دریچه قلب آنها فلزی و مجبور به استفاده دایمی از وارفارین هستند موکد اّ توصیه می کنند که هیچ گاه باردار نشوند . به همین دلیل دریچه هایی وجود دارد که به نام دریچه های بیولوژیک معروف است این دریچه ها نیازی به استفاده از وارفارین ندارد وخانم هایی که می خواهند بچه دار شوند به خواست خود آنها از این نوع دریچه برای آنها استفاده می شود .
وارفارین + یک داروی ضد انعقاد
بیمارانی هستند که با وجود مصرف وارفارین به مقدار لازم باز هم دچار عوارضی میشوند که نشان می دهد وارفارین به تنهایی برای آنها کافی نیست . در این گونه موارد که صرفاّ با تشخیص و نظر پزشک متخصص معین می شود از داروهایی استفاده می گردد که روی پلاکتهای خون تاثیر گذارده قابلیت انعقادی خون را بیشتر کاهش می دهد . مهمترین و مطمئن ترین داروی ضد پلاکتی شناخته شده آسپیرین است و گرچه توام ساختن وارفارین+ آسپیرین احتمال خونریزی و مخاطرات ناشی از خونریزی را افزایش میدهد و علاوه بر آن نیاز به مراقبت بیشتری از این گونه بیماران است اما شرایطی وجود دارد که راهی به جز استفاده توام از این دارو نیست .
در هر حال مصرف توام آسپیرین و وارفارین جز با نظر پزشک متخصص به هیچ وجه جایز نیست و هیچ بیمار قلبی نمی بایست بدون مشورت و اطلاع پزشک از آن استفاده نماید .
References
*https://cpmc.coriell.org/Sections/Drug%20Response/Warfarin.aspx?PgId=221
*http://swagene.com/cardio/warfarin/
*http://inrtracker.com/articles/diet/coumadin-diet
*http://www.entwellbeing.com.au/warfarin-diet/
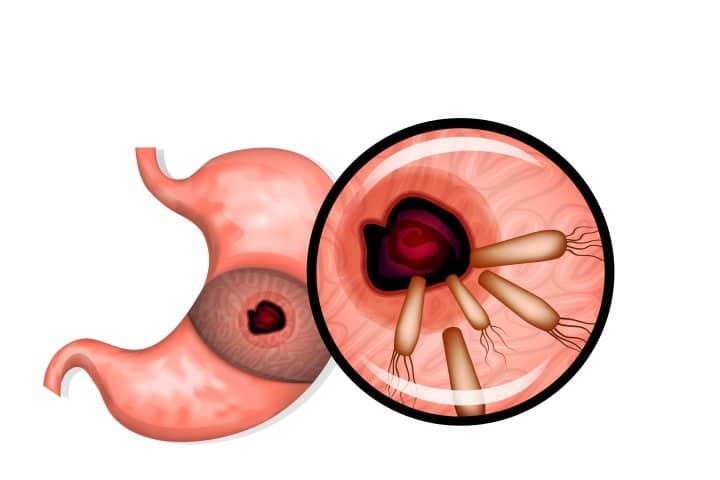
هلیکوباکتر پیلوری ( Helicobacter pylori)، گونهای از باکتری هلیکوباکتر است. بیش از نیمی از مردم دنیا به این باکتری آلوده هستندوعامل اصلی بیماریهایی مثل زخم معده و ناراحتیهای معده و ابتدای روده می باشد. هلیکوباکتر پیلوری باکتری مارپیچی است که میتواند به شکل کروی هم تغییر شکل پیدا کند . شکل کروی باکتری غیرقابل کشت میباشد ولی می تواند به مخاط معده متصل شود . هر دو شکل باکتری قابل زیست و بیماری زا هستند.
طولاین باکتری ۳ و قطر آن حدود نیم میکرومتر است. کم هوازی است و به وسیله آنزیم هیدروژناز با تجزیه ملکول هیدروژن تولید انرژی میکند. این باکتری همچنین تعدادی آنزیم تولید میکند که از مهمترین آنها میتوان سه آنزیم اکسیداز، کاتالاز و اورهآز را نام برد .
وجود پمپ پروتون(k+ / H+ ATPase) در سطح این باکتری که مشابه پمپ موجود در سلولهای دیوارهای معدهاست ، غیرعادی است. کار این پمپ حفظ گرادیان پروتون (یون مثبت) به نسبت یک میلیونیوم در دو طرف دیوارهباکتری است بصورتی که هر یون مثبتی را که به درون باکتری راه پیدا میکند به بیرون انتقال بدهد. در محیط معده به خاطر وجود اسید معده یون پروتون به میزان زیادی وجود دارد که اگر وارد باکتری بشود باعث نابودیش میشود، برای بر طرف کردن این مشکل این پمپ در سطح باکتری به وجود آمده، و یونهای مثبتی را که وارد باکتری بشوند به سرعت از باکتری خارج میکند.
هلیکوباکتر پیلوری گرم منفی میکروآئروفیلیک کند رشد است که در معده و دوازدهه یافت شده و با تعدادی از بیماریهای معده و دوازدهه ارتباط دارد. این باکتری با تولید فراوان آنزیم اوره آز که یک فاکتور بیماریزایی است و میتواند جهت تشخیص بکار رود، مشخص میگردد.
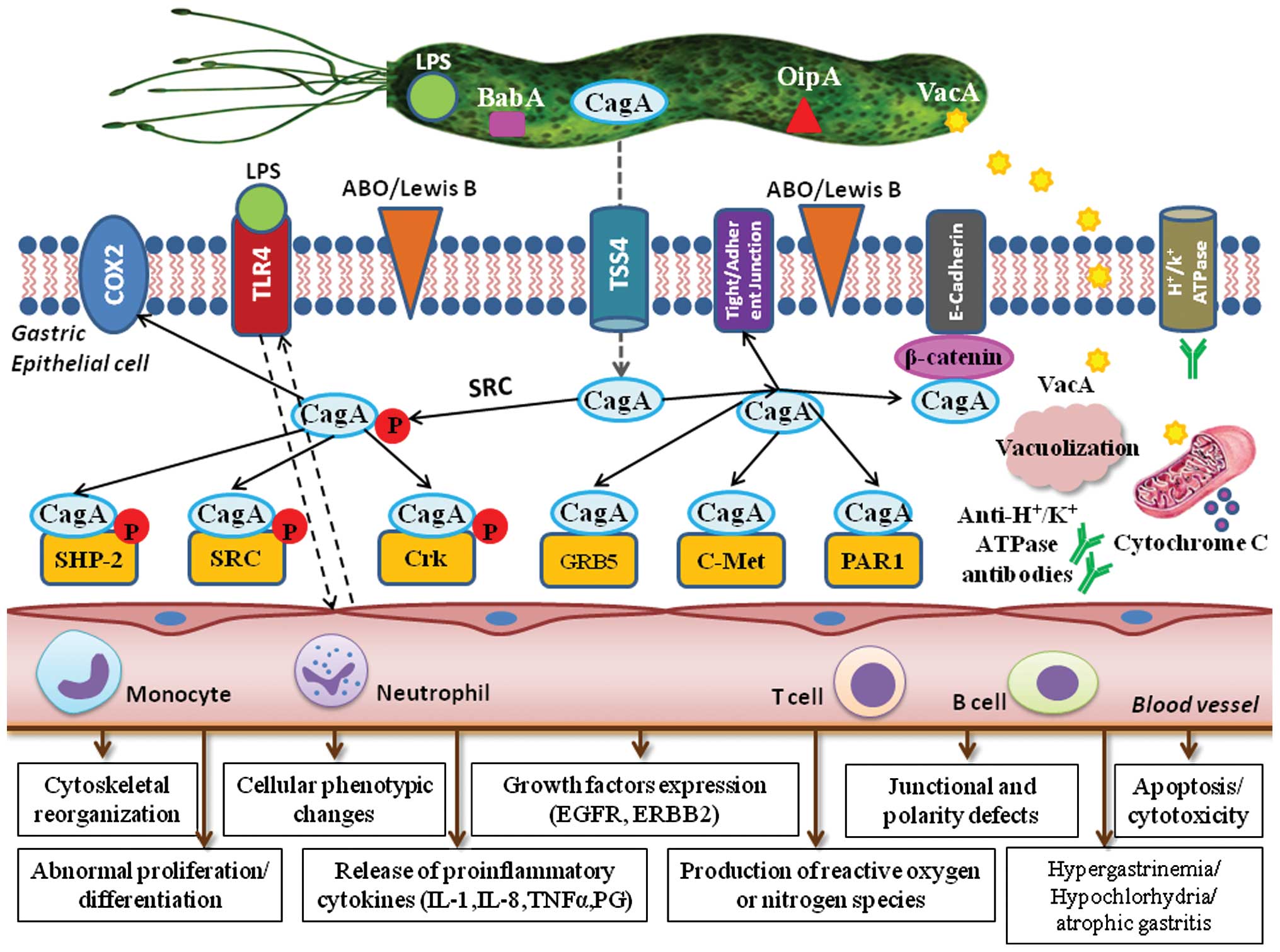
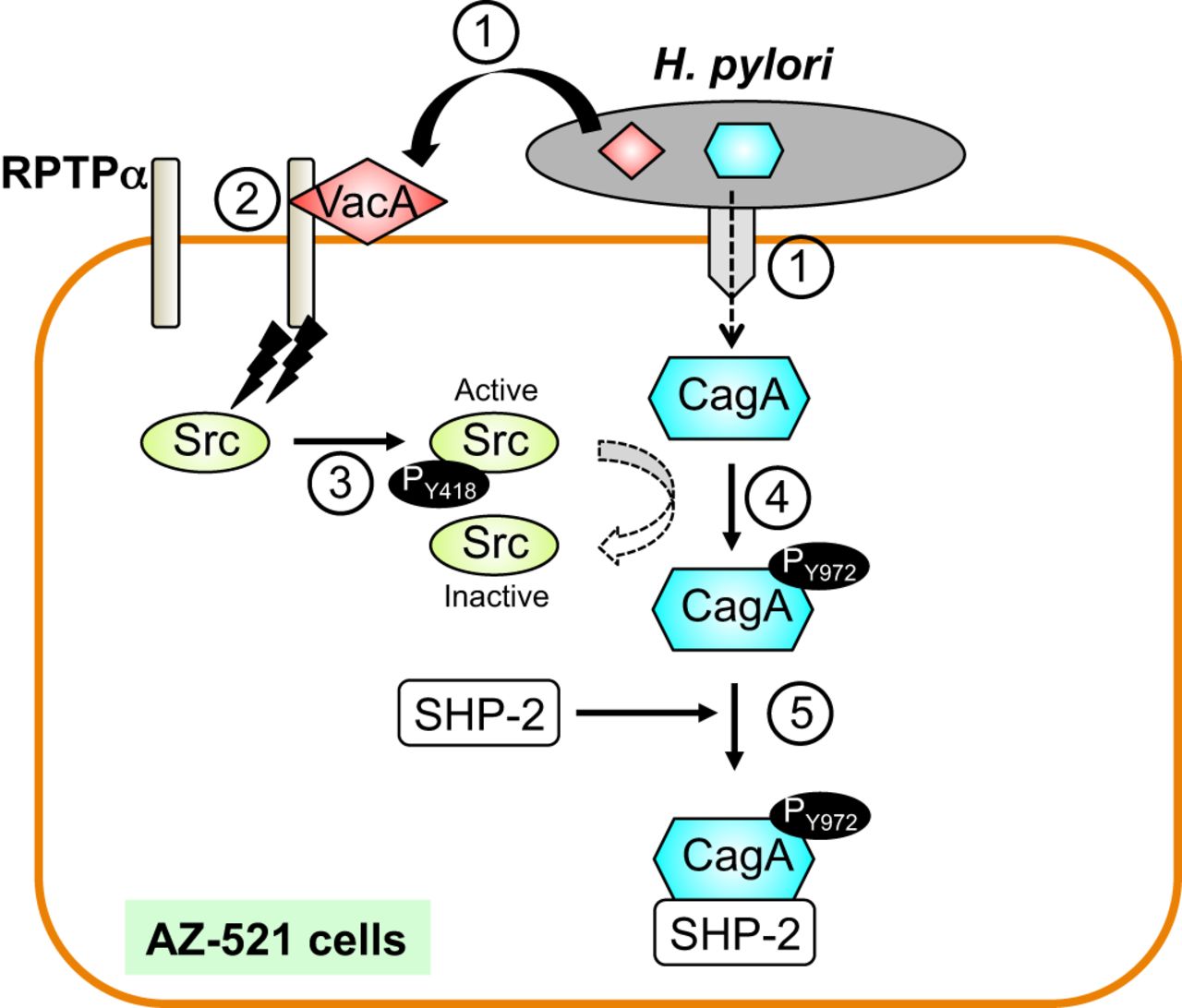
هلیکوباکتر پیلوری vacuoeling cytotoxin) VacA )و (CagA (cytotoxin-associated gene A که به نظر می رسد عامل بیماریزایی باشند را تولید می کند. این باکتری از یک اندام سوزنی شکل برای تزریق Cag A مثبت در محل تلاقی دو سلول لایه پوشاننده معده استفاده میکند. Cag A ، سمی است که سیتوتوکسین مرتبط با ژن A تولید میکند. تمام کروموزوم های این باکتری، ژن Cag A را حمل نمیکنند بلکه فقط آنهایی که تحت عنوان Cag A مثبت طبقهبندی شدهاند بدین عمل مبادرت میورزند. این سم ساختار سلولهای معده را تغییر داده و باعث میشود باکتریها آسانتر به آنها بچسبدو درمدت طولانی ، باعث التهاب مزمن بافت میشود.
اغلب موارد علایم آلودگی با این باکتری خفیف وگذرا به صورت تهوع،درد شکمی،اسهال وبی اشتهایی که خودبخود ویا با درمان مختصر است ودرپاره ای مواردبیمار هیچگونه عارضه خاصی را بیاد نمی آورد. اما در موارد دیگر برحسب ژنتیک فرد ومشخصات میکروب ، صدمه در پوشش درونی معده ایجاد شده والتهاب ،زخم ودرموارد نادر نوعی سرطان لایه درونی معده (لنفوم لایه درونی معده)ایجاد میشود.زخم میتواند در نواحی مختلف معده ودوازدهه ایجاد شود که درصورت عدم درمان مناسب میتواند درد،تهوع،بی اشتهایی ودرموارد شدیدتر خونریزی ویا سوراخ شدن زخم هم ایجاد شود.درموارد کمی ممکن است درطول زمان تغییرات ایجادشده در مخاط منجر به ایجاد سرطان معده شود.
آزمایشاتی مثل تست خونی، تست تنفسی وآزمایش مدفوع صرفا وجود میکروب را نشان میدهد و ضایعات ایجاد شده توسط میکروب مشخص نمی شود.با توجه به اینکه وجود میکروب به معنی وجودضایعه نیست وازطرف دیگر با این آزمایشات نمیتوان نوع صدمه ایجاد شده اعم از التهاب،زخم معده یا اثنی عشر وتغییرات دیگر را تشخیص داد لذا درصورت وجود علایم باید از روشهای تشخیص ضایعه که بهترین ودقیق ترین آن انجام آندوسکپی و مشاهده مستقیم وتشخیص ضایعه توسط پزشک مجرب ومتبحر درآندوسکپی ودر صورت نیاز نمونه برداری ازنواحی مختلف استفاده کرد.
درمورد درمان هلیکوباکتر در مورد برخی ضایعات مثل زخم معده یا دوازدهه و لنفوم(سرطان سطحی لایه درونی معده)اتفاق نظروجود دارد و درمان و ازبین بردن میکروب منجر به جلوگیری ازعود زخم وازبین رفتن سرطان سطحی لایه درونی(مالتوما) می شود.
اما در موارد دیگری مثل التهاب خفیف ویا مواردی که اساسا میکروب صرفا وجود دارد و ضایعه ایجاد نکرده است درمان نیازنیست زیرا برحسب محل جغرافیایی و بهداشت جامعه بین 50-80% افراد آلوده به میکروب هستند و از آنجا که برای درمان و ازبین بردن میکروب دو تا سه نوع آنتی بیوتیک لازم است ، درمان همه افراد منجر به تحمیل هزینه گزاف بر جامعه میشود واز طرف دیگر منجر به ایجاد مقاومت میکروبی و پیدایش میکروبهایی که به انواع آنتی بیوتیک ها مقاوم خواهند بود. علاوه برموارد فوق عوارض آنتی بیوتیک ها که در برخی موارد میتواند شدید باشد.
برای ازبین بردن هلیکوباکتر اغلب 2-3 انتی بیوتیک و معمولا همراه با داروهای کاهش دهنده اسید لازم است.مدت درمان معمولا 10-14 روز که در90% موارد منجر به ازبین رفتن میکروب میشود.در پاره ای موارد مورد لزوم ممکن است نیاز به تجدید دوره درمان با تعویض آنتی بیوتیک ها در موارد مقاومت آنتی بیوتیکی وبا حساسیت بیمار و یا عدم تحمل بیمار باشد.
هلیکوباکتر پیلوری علاوه بر زخم معده ، باعث بروز بعضی از سرطانهای گوارشی شده و مهمترین علت ایجاد سرطان معده و لنفوم MALT محسوب می گردد، اما این میکروب در همه افراد ایجاد سرطان نمیکند، حدود ۱۵٪ از بیمارانی که عفونت طولانی مدت دارند ممکن است یک یا چندین عارضه در معده آنها ایجاد شود. وضع بد اجتماعی، اقتصادی و تحصیلات پایین از عواملی هستند که احتمال بروز این عفونت را در فرد بالا میبرد. از عوامل دخیل دیگر تراکم جمعیت، زندگی در شرایط غیر بهداشتی، غذا یا آب آلوده و تماس با محتویات معده افراد آلوده را میتوان نام برد. انتقال این بیماری از راه فرد به فرد، و عمدتاً از راههای دهان به دهان یا دهانی مدفوعی انجام میشود.
عفونت با هلیکوباکتر پیلوری منجر به التهاب مدوام معده در همه افراد آلوده می شود، ولی این باکتری غیر مهاجم بوده و وارد سلول های مخاطی نمی شود. پاسخ میزبان به دنبال اتصال باکتری به سلولهای اپی تلیال شروع می شود و با آسیب به سلولهای مخاطی مواد آنتی ژنیک مترشحه از باکتری جذب سلولهای اپی تلیال معده شده و پس از عبوراز لامینا پروپریا (لایه زیر مخاطی) ، لنفوسیت ها را تحریک نموده و در نتیجه آنتی بادی بر علیه این باکتری از کلاس IgG ، IgA و بندرت از کلاس IgM ایجاد می شود. پس از درمان کامل تیتر آنتی بادی ها به تدریج کاهش می یابد. عفونت اولیه ناشی از H.pylori ایجاد مصونیت نمی نماید و احتمال عفونت مجدد (reinfection) زیاد است.
روش های تشخیص
عفونت هلیکوباکتر پیلوری با استفاده از روش های ذیل تشخیص داده می شود:
روش های تهاجمی
الف: بیوپسی آندوسکوپیک از مخاط معده و انجام تست اوره آز سریع ((Biopsy Urease Test) اولین انتخاب، بیوپسی مخاطی از ناحیه آنتر معده است که نمونه بیوپسی شده در درون محلول حاوی اوره قرار داده می شود. تغییر رنگ محیط نشانه تجزیه اوره توسط H.pylori و قلیایی شدن محیط است. حساسیت این روش 100-79 درصد و ویژگی آن 100-92 درصد است. برداشتن تعداد زیاد نمونه بخصوص از تنه معده (علاوه بر ناحیه آنتروم) سبب افزایش حساسیت تست می شود. موارد منفی کاذب در بیمارانی که دچار خونریزی فعال و یا خونریزی اخیر می باشند، کسانی که آنتی بیوتیک دریافت کرده اند و یا تحت درمان ضد ترشحی بوده یا هستند دیده می شود.
ب: بیوپسی آندوسکوپیک از مخاط معده و انجام کشت: فقط در موارد مقاومت به درمان برای بررسی حساسیت آن به آنتی بیوتیکها انجام می شود و بطور معمول برای تشخیص اولیه عفونت انجام نمی گیرد ، اما توصیه می شود در مواردی که درمان خط اول با شکست مواجه شد، انجام گیرد. این باکتری در دمای C°37 ، در یک محیط میکروآئروفیل طی 3 تا 6 روز بر روی محیط (skirrow) حاوی وانکومایسین، پلی میکسین B، تری متوپریم و یا شکلات آگار حاوی آنتی بیوتیکهای وانکومایسین، نالیدیکسیک اسید و آمفوتریسین رشد می کند.
روش های غیر تهاجمی
الف: آزمون های سرولوژیک:
روش های ارزانی هستند ولی از آنجائیکه سویه های H.pylori در مناطق جغرافیایی مختلف ، متفاوت هستند عدم استفاده از آنتی ژنهای بومی هر منطقه در کیت های تشخیصی آزمایشگاهی سبب کاهش حساسیت این تست ها می شود.
آنتی بادی از کلاس IgG در 95-94 درصد بیماران، تقریبأ 2 ماه پس از ورود باکتری به بدن مثبت شده و پس از ریشه کنی عفونت تا یک سال یا بیشتر مثبت باقی می ماند. ویژگی این تست حدود 71-41 درصد است که نشانه موارد بالای مثبت کاذب ، در اثر آنتی بادی بوجود آمده در سایر عفونت ها و ایجاد واکنش متقاطع با این تست است.
آنتی بادی از کلاس IgA نیز در 97-94 درصد بیماران ، تقریبأ 2 ماه پس از ورود باکتری به بدن مثبت شده و تقریبأ 3 الی 4 هفته پس از ریشه کنی عفونت سطح آن کاهش می یابد. ویژگی آن حدود 72-59 درصد است که نشانه موارد بالای مثبت کاذب در اثر آنتی بادی بوجود آمده در سایر عفونت ها و ایجاد واکنش متقاطع با این تست است.
آنتی بادی از کلاس IgM شاخص غیر حساس از عفونت حاد (با حساسیت حدود 28-14 درصد) بوده و کاربرد بالینی حتی در کودکان ندارد.
سطح این آنتی بادیها هیچگونه ارتباطی با شدت و وسعت عفونت ندارد. و از طرفی این تست ها قادر به افتراق فرم فعال بیماری از موارد بهبود یافته نمی باشند.
تست های سرولوژیکی در تعیین پروتکل درمان ، تأیید نتیجه درمان قطعی و تشخیص بیماری در کودکان استفاده محدودی داشته و قابل اعتماد نیستند. از طرفی درمان زودرس با داروهای ضد میکروبی در عفونت H.pylori پاسخ آنتی بادیها را مهار کرده و چنین بیمارانی مستعد عفونت مجدد می شوند.
ب: تست تنفسی اوره (Urea Breath Test):
این روش بر اساس است فعالیت آنزیم اوره آز هلیکوباکتر پیلوری است. اوره نشاندار 14C- or 13C- urea موجود در کپسول خوراکی که توسط بیمار خورده می شود به آمونیاک و CO2 حاوی کربن نشاندار شده، متابولیزه شده و CO2 از طریق مخاط به جریان خون انتشار یافته و از آنجا به شش ها و در نهایت به بازدم انتقال می یابد. با جمع آوری CO2 نشاندار موجود در بازدم میزان CO2 تولید شده در معده را می توان اندازه گیری نمود. اگر CO2 نشاندار آشکار گردد نشانه عفونت فعال هلیکوباکتر پیلوری می باشد. به علت دوز بسیار پایین داروی مورد استفاده در این تست، مصرف آن در موارد بارداری و همچنین کودکان مجاز می باشد.
حساسیت و ویژگی این روش که بیش از 94 درصد است (ارزش پیشگوئی کننده مثبت یا Positive Predictive Value آن 100-89% و ارزش پیشگوئی کننده منفی یا Negative Predictive Value آن 94-89%) برای تشخیص اولیه عفونت و پیگیری موفقیت درمان ریشه کن کننده به کار می رود. برای این منظورباید حداقل 4 هفته پس از اتمام دوره درمان مجددأ آزمایش تکرار شود. بنابراین روش مرجع (Gold Standard) برای پی گیری درمان می باشد.
این روش برای تشخیص H.pylori در اولسرهای پپتیک خونریزی دهنده و یا بدون خونریزی که Biopsy Urease Test آنها منفی شده است ، آدنوکارسینوم معده ، لنفوم MALT، سابقه مثبت فامیلی برای کانسر معده نیز استفاده می شود.
ج: تست تعیین آنتی ژن هلیکوباکتر پیلوری در مدفوع به روش PCR
این تست با حساسیت 98-89 درصد و ویژگی بالای 90 درصد راه آلترناتیو برای تست تنفسی اوره می باشد. تست های مدفوعی برای پیگیری درمان موثر قابل انجام و اعتماد هستند و باید 8 هفته پس از اتمام دوره درمان ، مورد استفاده قرار گیرند. اما روش بسیار گرانتری نسبت به تست های دیگر می باشد.
برای انجام تست UBT شرایط زیر باید رعایت شود:
- بیمار از 6 ساعت قبل ناشتا باشد
- عدم مصرف آنتی بیوتیک، بیسموت و داروهای ضد ترشحی (مثل امپرازول و ...) 4 هفته قبل از انجام آزمایش
- عدم مصرف انواع آنتی اسید و بلوک کننده های H2 (مثل سایمتدین، رانیتیدین و ...) 7 روز قبل از انجام آزمایش
| جدول مقایسه خصوصیات تست های روتین در تشخیص هلیکوباکتر پیلوری | ||||
| نوع آزمایش | زمان مثبت شدن آزمایش بعد از ورود باکتری به بدن | مدت زمان منفی شدن آزمایش پس از درمان |
حساسیت (Sensitivity) |
ویژگی (Specificity) |
| H.pylori IgG | 8 هفته | بیشتر از یکسال | 94–95 % | 41–71 % |
| H.pylori IgA | 8 هفته | 3– 4 هفته | 94–97 % | 59- 72 % |
| H.pylori IgM | 3–4 هفته | 2–3 ماه | 14–28 % | 54–61 % |
| UBT | 2–3 هفته | 4 هفته | 94–98 % | 95–100 % |

منابع :
http://www.govaresh.org/index.php/dd
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3109773/
http://www.cell.com/cell-host-microbe/abstract/S1931-3128(14)00066-3
http://dmm.biologists.org/content/9/12/1473
Diabetes mellitus
دیابتیابیماری قندیک اختلال متابولیک در بدن است. در ان بیماری توانایی تولید هورمون انسولیندر بدن از بین میرود یا بدن در برابر انسولین مقاوم شده و بنابراین انسولین تولید شده نمیتواند عملکرد طبیعی خود را انجام دهد. نقش اصلی انسولین کاهش قند خون توسط مکانیسم های مختلف است. دیابت دو نوع اصلی دارد. در دیابت نوع یک، تخریب سلولهای بتا درپانکراس باعث نقص در تولید انسولین میشود و در نوع دوم مقاومت پیش رونده بدن به انسولین دیده می شود که در نهایت ممکن است به تخریب سلولهای بتای پانکراس و نقص کامل تولیدانسولینمنجر شود. در دیابت نوع دو مشخص است که عواملژنتیکی، چاقی و کمتحرکی نقش مهمی دارند.
آزمایش های بیوشیمی خون
آزمایش های بیوشیمی شامل گلوکز ، اوره ، کلسترول ، تری گلیسرید ،اسید اوریک و......است. بیشتر این آزمایشات نیاز به ناشتا بودن دارند.
راهنمای شرایط ناشتایی برای انجام آزمایش
رعایت شرایط ناشتایی برای انجام برخی آزمایشات مانند آزمایش گلوکز ناشتا ،کلسترول ، تری گلیسرید ، فسفر و.... الزامی است ، زیرا خوردن غذا می تواند موجب ایجاد تغییرات در آزمایشات نامبرده گردد.
مواردی که رعایت آن در وضعیت ناشتا الزامی است
برای آزمایش گلوکز ناشتا، 8ساعت قبل از مراجعه به آزمایشگاه هیچ غذا یا آشامیدنی (بجز آب) نخورید. زمان پیشنهاد شده مخصوص شب است تا فعالیت های بدن در طی این مدت به حداقل برسد و در این حالت بیمار در شرایط مناسب نمونه گیری در اول صبح قرار خواهد گرفت.
در صورتی که آزمایش های مربوط به چربی خون مثل تری گلیسرید و کلسترول درخواست شده باشد ، مدت زمان ناشتایی 10تا 12 ساعت است.
اهمیت تغذیه در دوران بلوغ،علایم کم خونی فقر آهن و... مواردی هستند که به آن می پردازیم
دختران امروز ،مادران فرداوکلیدسلامتی نسل کنونی وآینده می باشند.دخترانی که به هر دلیل با تغذیه ناکافی دچار کمبودهای تغذیه ای می شوند با کاهش قدرت
یادگیری ،افت تحصیلی،افزایش ابتلا به بیماری ها وکاهش توانمندی ذهنی وجسمی مواجه هستند وپس از ازدواج نمی توانند دوران بارداری وشیردهی خوبی داشته باشند چراکه در دوران بارداری وشیردهی ذخایر بدن مادر مصرف می شود وسو تغذیه اوتشدید یافته وعلاوه بر مادر گریبان گیر فرزندانش نیز میشود.
یکی از موارد مغذی حیاتی مورد نیاز بدن آهن است.آهن اساسی ترین ماده اولیه برای ساخت گلبولهای قرمز خون است.علاوه بر آهن مواد مغذی دیگری مثل
پروتیین ،اسیدفولیک B6، ویتامین ویتامین B12 و ویتامین C برای ساخته شدن گلبولهای قرمز مورد نیاز است که بایداز طریق رژیم غذایی روزانه تامین شود.
نقش گلبول قرمز انتقال اکسیژن به سلولهای بدن است.
عضویت در خبرنامه
تمامی حقوق مادی و معنوی این وبسایت متعلق به آزماشگاه الزهرا می باشد
طراحی شده با ♥ توسط دانش آفرینان نوین هیوا